|
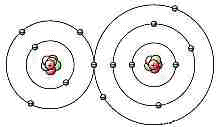
Há mais de 100 espécies de átomos.
A maioria destes átomos é estável no curto período
de tempo dos humanos. Devido a energia residual que sobra, além
da força eletromagnética de ligação dos elétrons
atômicos aos núcleos, os átomos podem atrair, e ligar-se
a, outros átomos. Quando isto acontecer, a estrutura formada é
chamada de molécula.
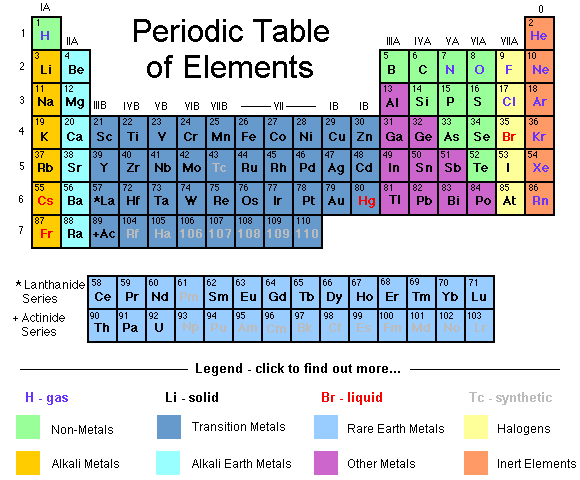
As diferentes espécies de átomos estão
arranjadas numa tabela de acordo com quantos elétrons eles tem.
Esta tabela é chamada Tabela
Periódica.
Se você tiver o
programa plug-in Acrobat Reader então poderá obter uma tabela
periódica que pode ser impressa, clicando aqui.
Todos os tipos de propriedades de materiais podem surgir
da estrutura dos seus átomos e das suas moléculas. Os átomos
podem ser classificados em duas categorias: metais
e não-metais. Também há
uma categoria híbrida onde os átomos exibem características
de metal e de não-metal. Esta categoria de átomo é
chamada metalóide. Muitos metalóides são alternativamente
chamados de semicondutores. Este grupo de elementos inclui o boro, o silício,
o germânio, o arsênico, o antimônio, o telúrio
e astatine. Dos átomos até agora conhecidos, só 17
mostram características principalmente não-metálicas,
outros 7 são metalóides, e o resto (mais de 80) podem ser
classificados como metais.
|
Propriedades
dos metais incluem:
|
 |
1.Eles são
bons condutores de calor e eletricidade.
|
 |
2.Eles são
usualmente opacos à luz
|
 |
3.Eles tem afinidade
eletrônica
|
|
|
Propriedades
dos não-metais incluem:
|
 |
1.Eles são
péssimos condutores.
|
 |
2.Eles são
mais frágeis e menos maleáveis no seu estado
sólido.
|
 |
3.Não mostram
afinidades eletrônicas.
|
 |
4.Eles podem ser
transparentes ou translúcidos.
|
 |
5.Eles tem baixa
densidades.
|
 |
6.Eles são
gases, líquidos ou sólidos.
|
 |
7.Eles formam
moléculas que consistem de átomos ligados
covalentemente; os gases nobres são monoatômicos.
|
|
|
Propriedades
dos metalóides incluem:
|
 |
1.Eles podem ser
bons condutores de calor e de eletricidade. Isto depende
de como eles são tratados. Eles também podem
se tornarem isolantes.
|
 |
2.Eles são
maleáveis e dúteis no seu estado sólido.
|
 |
3.Eles mostram
afinidade eletrônica.
|
 |
4.Eles são
opacos.
|
 |
5.Eles têm
alta densidade.
|
 |
6.Eles são
sólidos (exceto o mercúrio)
|
 |
7.Eles tem estruturas
cristalinas em que cada átomo é envolvido
por oito a doze vizinhos mais próximos.
|
|
Informações adicionais sobre a Tabela
Periódica podem ser encontradas em
Web
Elements - Periodic Table On The WWW Os átomo se juntam (chamadas ligações
químicas) usando a força eletromagnética numa variedade
de modos.
|
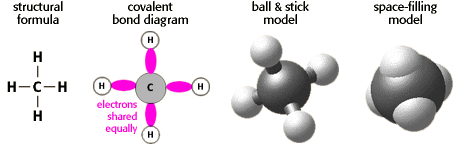
Ligação
Covalente
|
A molécula de metano
é mantida junta por este tipode ligação.
De fato com o metano existem quatro ligações covalentes
entre o carbono e o hidrogênio.
|
|
Se átomos estão
repartindo elétrons, então a ligação
entre eles é covalente.
|
 |
|
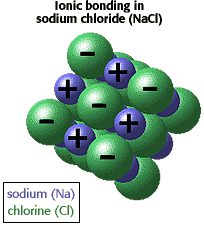
Ionic
bonding
|
Átomos podem obter
um número estável de elétrons doando ou recebendo
elétrons. Por exemplo, Na (sódio) pode doar um elétron
ao Cl (cloro) gerando Na+ e Cl-. O par iônico é mantido
junto por atrações eletrostáticas fortes.
Isto é chamado de ligação iônica.
|
|
Se um átomo "deseja"
ardentemente um elétron para completar sua camada exterior,
ele vai "roubar" o elétron de outro átomo.
Os dois átomos terminarão então com uma carga
global desequilibrada, um fica carregado positivamente enquanto
o outro fica carregado negativamente. Esta situação
de cargas-opostas precipita a formação de uma ligação
iônica forte entre eles.
|
 |
|
Pontes
de Hidrogênio
|
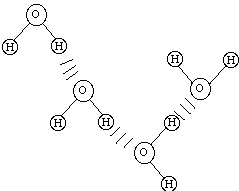
Pontes de Hidrogênio
são ligações fracas formadas quando um átomo
de hidrogênio é compartilhado entre duas moléculas.
|
|
Na água (H2O),
um átomo de hidrogênio é atraído para
não somente o oxigênio na sua própria molécula
mas também é atraído para o oxigênio
dos átomos vizinhos também.
|
 |
Há outras ligações secundárias
que são fracas mas às vezes provam ser importantes em moléculas
complicadas. Estas ligações não serão discutidas
aqui. Ligações moleculares em moléculas complicadas
são uma combinação de todas as ligações
acima.
|
A estrutura mais
comuns dos materiais dependem
|
|
- do comportamento
dos elétrons mais externos num estado relativamente livre
de um cristal (o que é levado em conta em todos os metais
com uma estrutura cristalina bem compacta);
|
 |
|
- do comportamento
único do átomo de hidrogênio (tão importante
em muitos materiais orgânicos);
|
|
- das propriedades
muito especiais de um par de átomos formando ligações
altamente dirigidas numa
configuração tetraédrica.
|
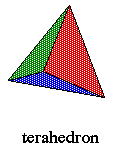 |
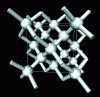
Um exemplo de um arranjo tetraédrico de átomos
pode ser achado no diamante. O diamante é uma combinação
de quatro átomos de carbono em uma forma de tetraedro. Um átomo
de carbono é unido a quatro átomos de carbono distintos.
Este arranjo se mostra extremamente estável e o diamante se torna
um dos materiais mais fortes que conhecemos.
|
Duas maneiras de se ligar
os átomos de carbono consigo mesmo produzem diferenças
impressionantes
|
 |
|
Arranjo dos átomos
de carbono no diamante
|
 |
 |
|
O arranjo dos átomos
de carbono no grafite.
|
 |
 |
Em geral, o carbono é o campeão de ligação
de todos os átomos. Une-se a quase todos os outros átomo
ligáveis e liga-se com si mesmo de vários modos. Como uma
conseqüência, pode produzir cadeias longas de arranjos moleculares
complexos. Toda a química orgânica está baseada nos
arranjos dos átomos de carbono com os outros átomos tais
como o nitrogênio, o oxigênio e o hidrogênio.
|
O átomo de silício tem um arranjo
eletrônico externo semelhante daquele do carbono.
|
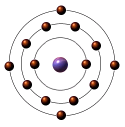 |
O Silício forma a molécula de dióxido
de silício ( SiO2) num arranjo tetraédrico. O
dióxido de silício é o principal constituinte de
todos os silicatos e daí é o constituinte maior das rochas,
areias, cimentos, vidros e cerâmicas.
|
Estes
dois elementos, carbono e silício, são extremamente
abundantes na Terra. Eles tem configurações eletrônicas
que dão origem à moléculas que tem propriedades
muito interessantes.
|
|
O Carbono
dá origem a toda biologia
na Terra
|
O
Silício dá origem a toda
geologia
|
 |
 |
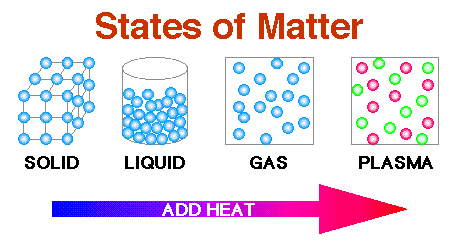
Next we look at what happens when we have large collections of
molecules. Uma quantidade típica de material macroscópico,
digamso 1 grama, contém cerca de6 x 1023
moléculas. Este é o chamado Número
de Avogadro. Este número é absolutamente enorme!
Para se ter uma idéia de quão grande é este número
considere o seguinte exemplode visualização. Espalhando
6.02 x 1023 bolinhas de gude sobre toda a superfície
da Terra você produziria uma camada de cerca de 5 km de espessura. Moléculas
e átomos, quando juntados em números da odem do Número
de Avogadro podem tomar formas macroscópicas definidas que chamamos
estados da matéria ou fases da matéria.
 |
|
Como mostra os diagramas
anteriores, quando a energia (o que nós chamamos calor)
é acrescentado a coleções macroscópicas
de moléculas ou átomos, quatro possíveis
estados de matéria resultam. Plasma é o estado de
matéria onde a energia é tão alta que a neutralidade
atômica é destruída e os átomos tornam-se
carregados. Este tipo de matéria era de grande importância
nos primeiros instantes iniciais do universo.
|
|
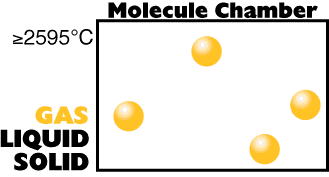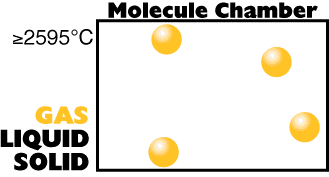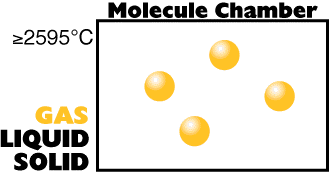
Considere
as três fases normais da matéria no caso particular
do átomo de cobre.
|
|
Temperatura Alta (grande
quantidade de energia interna)
|
 |
|
Uma temperatura mais baixa
(menos energia interna)
|
 |
|
A mais baixa temperatura
(energia interna tão pequena quanto você possa obter)
|
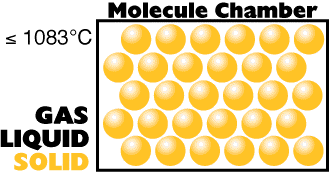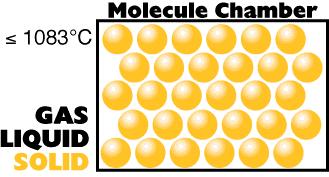 |
|